
Россия и США начнут сотрудничать в сфере обеспечения контроля за оборотом лекарственных средств и согласования действующих в обеих странах нормативов по качеству и составу препаратов.
Эта работа будет вестись в соответствии с меморандумом о взаимопонимании, подписанным между Федеральной службой по надзору в сфере здравоохранения и социального развития (Роздравнадзор) и Фармакопейной конвенцией США (USP).
Пресс-секретарь Росздравнадзора Максим Лакомкин сообщил корреспонденту «Газеты», что одним из основных направлений деятельности станет информационное взаимодействие, которое, в частности, позволит обеим сторонам принимать оперативные меры в случае попадания в продажу недоброкачественных субстанций и фальсифицированных лекарств. По его словам, руководители ведомств Николай Юргель и Роджер Л. Уильямс обсудили возможность проверок и тестирования продукции фармпроизводителей, работающих на американском и российском рынках.
«Мы рассматриваем возможность участия представителей Росздравнадзора и российского научного сообщества в разработке и совершенствовании стандартов, а также надеемся видеть российских специалистов в качестве членов экспертного совета Фармакопеи», - заявил Уильямс.
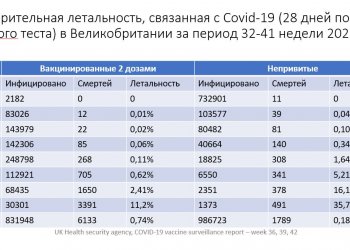
Согласно оценкам экспертов, сегодня доля поддельных препаратов на отечественном рынке составляет 0,1%, недоброкачественных (изготовленных с нарушениями стандартов, просроченных и т.п.) -- 4--5%. По данным Росздравнадзора, в 2008 году было выявлено и изъято 37 торговых наименований 81 серии фальшивых лекарств, 6 наименований 187 фальшивых субстанций и 1190 серий готовых лекарств из этих субстанций. Оперативный обмен информацией о выявленных недоброкачественных субстанциях и компонентов поможет с большей эффективностью изымать из обращения сделанные на их основе препараты, которые могут представлять серьезную опасность. Уильямс привел в пример массовую гибель пациентов в американских больницах в 2008 году: причиной смерти почти 200 человек стал раствор гепарина, произведенный из недоброкачественной китайской субстанции.
Получив тогда информацию от американских коллег, Росздравнадзор ужесточил контроль качества, изъяв из обращения все серии недоброкачественных субстанций гепарина и готовых лекарств, сделанных на их основе.
Ранее Росздравнадзор подписал аналогичные меморандумы с коллегами из Китая и Индии, откуда на российский рынок попадает основная масса сырья для изготовления лекарств, а также с контролирующими ведомствами стран СНГ и Европейским директоратом по качеству медицинской продукции. В Росздравнадзоре корреспонденту "Газеты" сообщили, что в нынешнем году служба, возможно, также подпишет соглашение о сотрудничестве с американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
Фармакопейная конвенция США - организация, которая разрабатывает федеральные стандарты качества рецептурных и безрецептурных лекарств, пищевых ингредиентов и добавок. Существует с 1820 года.
Источник: ГАЗЕТА.GZT.RU
Эта работа будет вестись в соответствии с меморандумом о взаимопонимании, подписанным между Федеральной службой по надзору в сфере здравоохранения и социального развития (Роздравнадзор) и Фармакопейной конвенцией США (USP).
Пресс-секретарь Росздравнадзора Максим Лакомкин сообщил корреспонденту «Газеты», что одним из основных направлений деятельности станет информационное взаимодействие, которое, в частности, позволит обеим сторонам принимать оперативные меры в случае попадания в продажу недоброкачественных субстанций и фальсифицированных лекарств. По его словам, руководители ведомств Николай Юргель и Роджер Л. Уильямс обсудили возможность проверок и тестирования продукции фармпроизводителей, работающих на американском и российском рынках.
«Мы рассматриваем возможность участия представителей Росздравнадзора и российского научного сообщества в разработке и совершенствовании стандартов, а также надеемся видеть российских специалистов в качестве членов экспертного совета Фармакопеи», - заявил Уильямс.
Согласно оценкам экспертов, сегодня доля поддельных препаратов на отечественном рынке составляет 0,1%, недоброкачественных (изготовленных с нарушениями стандартов, просроченных и т.п.) -- 4--5%. По данным Росздравнадзора, в 2008 году было выявлено и изъято 37 торговых наименований 81 серии фальшивых лекарств, 6 наименований 187 фальшивых субстанций и 1190 серий готовых лекарств из этих субстанций. Оперативный обмен информацией о выявленных недоброкачественных субстанциях и компонентов поможет с большей эффективностью изымать из обращения сделанные на их основе препараты, которые могут представлять серьезную опасность. Уильямс привел в пример массовую гибель пациентов в американских больницах в 2008 году: причиной смерти почти 200 человек стал раствор гепарина, произведенный из недоброкачественной китайской субстанции.
Получив тогда информацию от американских коллег, Росздравнадзор ужесточил контроль качества, изъяв из обращения все серии недоброкачественных субстанций гепарина и готовых лекарств, сделанных на их основе.
Ранее Росздравнадзор подписал аналогичные меморандумы с коллегами из Китая и Индии, откуда на российский рынок попадает основная масса сырья для изготовления лекарств, а также с контролирующими ведомствами стран СНГ и Европейским директоратом по качеству медицинской продукции. В Росздравнадзоре корреспонденту "Газеты" сообщили, что в нынешнем году служба, возможно, также подпишет соглашение о сотрудничестве с американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).
Фармакопейная конвенция США - организация, которая разрабатывает федеральные стандарты качества рецептурных и безрецептурных лекарств, пищевых ингредиентов и добавок. Существует с 1820 года.
Источник: ГАЗЕТА.GZT.RU













Комментарии (0)