
МОСКВА, 24 июня. /АМИ-ТАСС/ Вопросы подготовки изменений в Административный регламент Федеральной службы по надзору в сфере здравоохранения и социального развития /Росздравнадзор/ по регистрации изделий медицинского назначения обсуждались на заседании рабочей группы, которое прошло на прошлой неделе в Росздравнадзоре. Как сообщили сегодня в ведомстве, изменения в действующий регламент подготовлены Росздравнадзором и касаются регистрации реагентов для лабораторной диагностики in vitro, в том числе по классификации и введению понятий «открытая» и «закрытая система». Было принято решение представленные материалы по регистрации реагентов для лабораторной диагностики in vitro доработать и, после согласования с профессиональными ассоциациями, представить в Росздравнадзор.
Также рабочая группа рассмотрела вопросы подготовки перечня руководств для использования в работе организациями-производителями и заявителями при подготовке документов для экспертизы и регистрации изделий медицинского назначения. Все присутствующие на заседании сошлись во мнении, что они должны быть едиными для отечественной и зарубежной продукции. Участники совещания приняли решение о доработке проектов методических рекомендаций и с учетом рекомендаций профессиональных ассоциаций.
Одной из основных задач рабочей группы является коллегиальное рассмотрение вопросов исполнения государственных функций и повышение эффективности контрольно-надзорных действий Росздравнадзора, отметил замруководителя ведомства Андрей Младенцев. «Результатом совместной работы являются предложения по внесению изменений в нормативно-правовые акты или подготовка документов, информирующих отрасль, каким образом принимаются решения сотрудниками Росздравнадзора, - продолжил чиновник. - Мы проанализировали более чем годовой практический опыт реализации норм, заложенных в приказе Минздравсоцразвития «Об утверждении административного регламента Росздравнадзора по исполнению государственной функции по регистрации изделий медицинского назначения» и рабочая группа находится на финальной стадии подготовки предложений по внесению изменений и дополнений в этот документ», - сказал Младенцев.
Также рабочая группа рассмотрела вопросы подготовки перечня руководств для использования в работе организациями-производителями и заявителями при подготовке документов для экспертизы и регистрации изделий медицинского назначения. Все присутствующие на заседании сошлись во мнении, что они должны быть едиными для отечественной и зарубежной продукции. Участники совещания приняли решение о доработке проектов методических рекомендаций и с учетом рекомендаций профессиональных ассоциаций.
Одной из основных задач рабочей группы является коллегиальное рассмотрение вопросов исполнения государственных функций и повышение эффективности контрольно-надзорных действий Росздравнадзора, отметил замруководителя ведомства Андрей Младенцев. «Результатом совместной работы являются предложения по внесению изменений в нормативно-правовые акты или подготовка документов, информирующих отрасль, каким образом принимаются решения сотрудниками Росздравнадзора, - продолжил чиновник. - Мы проанализировали более чем годовой практический опыт реализации норм, заложенных в приказе Минздравсоцразвития «Об утверждении административного регламента Росздравнадзора по исполнению государственной функции по регистрации изделий медицинского назначения» и рабочая группа находится на финальной стадии подготовки предложений по внесению изменений и дополнений в этот документ», - сказал Младенцев.


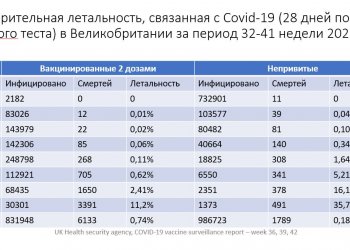











Комментарии (0)