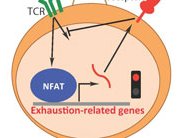
 В процессе борьбы с вирусными инфекциями или раковыми опухолями ключевое подразделение иммунитета — CD8 T-клетки — иногда теряет способность эффективно бороться с захватчиками. Преодоление так называемого истощения T-клеток крайне важно для лечения инфекций, хотя основные молекулярные механизмы остаются плохо изученными. И вот теперь группа ученых из института аллергии и иммунологии Ла Йолла сообщила, что изменением тайно руководит ядерный фактор активированных Т-клеток (NFAT), хорошо известный благодаря его решающей роли в поддержании CD8 Т-клеток боевой готовности. Результаты опубликованы в издании Immunity.
В процессе борьбы с вирусными инфекциями или раковыми опухолями ключевое подразделение иммунитета — CD8 T-клетки — иногда теряет способность эффективно бороться с захватчиками. Преодоление так называемого истощения T-клеток крайне важно для лечения инфекций, хотя основные молекулярные механизмы остаются плохо изученными. И вот теперь группа ученых из института аллергии и иммунологии Ла Йолла сообщила, что изменением тайно руководит ядерный фактор активированных Т-клеток (NFAT), хорошо известный благодаря его решающей роли в поддержании CD8 Т-клеток боевой готовности. Результаты опубликованы в издании Immunity.«Понимание молекулярного механизма, который приводит к истощению CD8 T-клеток, подводит нас на шаг ближе к развитию стратегий вызова оптимальных Т-клеточных реакций, которые могут успешно изгонять инфекции и убивать раковые клетки», пояснила постдок и соавтор Рената Перейра. „С другой стороны, это может позволить нам столкнуться с аутоиммунными реакциями, которые, как это ни парадоксально, основаны на том же белке“.
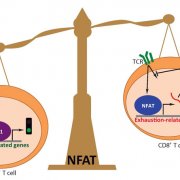 CD8 T-клетки — это подмножество лимфоцитов, заряженных на уничтожение раковых клеток и клеток, инфицированных вирусами, либо угрожающих другими способами. Ранее ученые определили NFAT как молекулярный центр, который организует активацию Т-клеток. Когда рецептор Т-клеток на поверхности CD8 Т-клеток распознает инородный белок, он запускает сигнальный каскад, который достигает высшей точки в активации NFAT и AP-1. Вместе эта пара связывается с регулирующими областями генома и запускает генетическую программу, которая активирует Т-клетки и готовит их к борьбе с раком и вирусными инфекциями. Сталкиваясь с хроническими вирусными инфекциями, такими как гепатит и ВИЧ, а также определенные виды раковых опухолей, CD8 Т-клетки надолго частично теряют эффективность, игнорируя призывы к оружию. Кроме того, истощенные CD8 Т-клетки начинают выражать блокирующие поверхностные клеточные рецепторы, которые получают и направляют запрещающие сигналы в клетку, устанавливая отрицательную петлю обратной связи. Хотя был описан целый спектр клеточных маркеров истощения, таких как PD-1 и TIM3, и, более того, эти маркеры были целью препаратов раковой иммунотерапии, молекулярные детали того, как CD8 Т-клетки переключаются, не были определены. Используя в качестве стартовой точки NFAT, Перейра и Густаво Мартинез установили, что вмешательство в партнерство NFAT и AP-1 склоняет баланс к истощению Т-клеток и ослабляет реакцию иммунитета на опухоли и инфекции.
CD8 T-клетки — это подмножество лимфоцитов, заряженных на уничтожение раковых клеток и клеток, инфицированных вирусами, либо угрожающих другими способами. Ранее ученые определили NFAT как молекулярный центр, который организует активацию Т-клеток. Когда рецептор Т-клеток на поверхности CD8 Т-клеток распознает инородный белок, он запускает сигнальный каскад, который достигает высшей точки в активации NFAT и AP-1. Вместе эта пара связывается с регулирующими областями генома и запускает генетическую программу, которая активирует Т-клетки и готовит их к борьбе с раком и вирусными инфекциями. Сталкиваясь с хроническими вирусными инфекциями, такими как гепатит и ВИЧ, а также определенные виды раковых опухолей, CD8 Т-клетки надолго частично теряют эффективность, игнорируя призывы к оружию. Кроме того, истощенные CD8 Т-клетки начинают выражать блокирующие поверхностные клеточные рецепторы, которые получают и направляют запрещающие сигналы в клетку, устанавливая отрицательную петлю обратной связи. Хотя был описан целый спектр клеточных маркеров истощения, таких как PD-1 и TIM3, и, более того, эти маркеры были целью препаратов раковой иммунотерапии, молекулярные детали того, как CD8 Т-клетки переключаются, не были определены. Используя в качестве стартовой точки NFAT, Перейра и Густаво Мартинез установили, что вмешательство в партнерство NFAT и AP-1 склоняет баланс к истощению Т-клеток и ослабляет реакцию иммунитета на опухоли и инфекции.«NFAT смещает баланс между активированным состоянием и истощением посредством связывания с различными подмножествами регулирующих областей генома», добавила профессор Аньяна Рао. Пристальный взгляд на транскриптом — совокупность активных частей генома, экспрессируемых в определенное время — подтвердил, что NFAT, действуя самостоятельно, вызывает вторую транскрипционную программу, обладающую множеством характерных особенностей истощения CD8 Т-клеток.
«В зависимости от доступности AP-1, NFAT склоняет чашу весов в пользу активации или истощения Т-клеток», отметил Мартинез. При наличии AP-1 NFAT вызывает активацию Т-клеток, а в его отсутствии запускает негативную регулирующую программу, которая активирует гены, которые кодируют блокирующие маркеры клеточной поверхности, и притупляет сигналы, полученные рецепторами Т-клеток. Также она сталкивается со способность CD8 Т-клеток вырабатывать цитокины, химические посыльные, которые рекрутируют остальное вооружение иммунитета.













Комментарии (0)